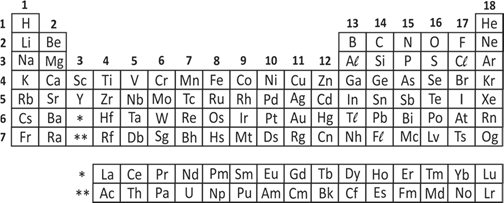
Analise a tabela periódica e as seguintes afirmações a respeito do elemento químico enxofre (S):
- Tem massa atômica maior do que a do selênio (Se).
- Pode formar com o hidrogênio um composto molecular de fórmula H2.
- A energia necessária para remover um elétron da camada mais externa do enxofre é maior do que para o sódio (Na).
- Pode formar com o sódio (Na) um composto iônico de fórmula Na3
São corretas apenas as afirmações
- I e II.
- I e III.
- II e III.
- II e IV.
- III e IV
Tags – Química, Tabela periódica, propriedades periódicas, Massa atômica, Energia de Ionização, Ligações químicas, regra do octeto.
Resolução
Analisando cada uma das afirmações:
- Falsa. A massa atômica pode ser estimada pela soma da massa dos prótons e dos nêutrons de um átomo. A massa dos elétrons não é considerada por ser 1836 vezes menor que a do próton e essa estimativa nem sempre é exata devido a um fenômeno chamado defeito de massa, que é quantificado como a diferença entre a soma das massas dos neutros e dos prótons e a massa real do átomo e que é considerado como uma medida da estabilidade do núcleo. Por isso, salvo algumas exceções, a massa atômica segue a sequência da tabela periódica – que é disposta em ordem crescente de número atômico – e como o enxofre (S) está antes do selênio (Se), a massa atômica do enxofre é menor do que a do selênio.
- Verdadeira. O enxofre (S) é da família 16 (6ª – Calcogênios), portanto apresenta 6 elétrons na camada de valência e se estabiliza com 8, logo precisa de mais 2 elétrons para se estabilizar. Como o hidrogênio possui 1 elétron na camada de valência e se estabiliza com 2, ele se estabiliza na molécula H2S compartilhando 1 elétron, cada hidrogênio, com o enxofre.
- Verdadeira. A energia necessária para remover um elétron da camada mais externa do elemento é chamada de Energia de Ionização e ela é uma das propriedades periódicas (propriedades periódicas são propensões a certas características que alguns elementos químicos seguem de acordo com sua posição na tabela periódica). Assim, em uma mesma família a energia aumenta de baixo para cima e em um mesmo período a Energia de Ionização aumenta da esquerda para a direita, conforme a ilustração:
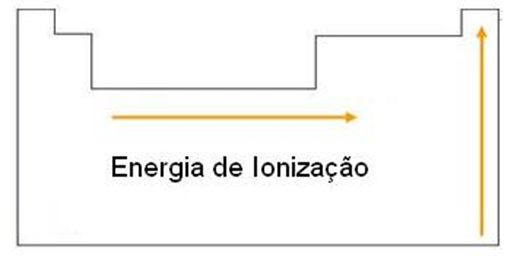
Essa propriedade possui esse comportamento, pois quanto mais camadas eletrônicas (que aumentam com as linhas da tabela periódica), mais distante está o último elétron do núcleo e menor a força que este exerce sobre aquele, sendo necessário uma energia menor para remover o elétron. Ademais, quanto maior o número de prótons, maior a carga nuclear e, portanto, maior a força de atração sobre os elétrons, sendo necessária mais energia para removê-lo.
Como o enxofre (S) e o sódio (Na) estão no mesmo período (mesmo número de camadas), o enxofre apresenta maior energia de ionização por estar mais à direita (maior número de prótons).
IV. Falsa. O sódio (Na) é um elemento muito eletropositivo e possui 1 elétron na camada de valência, que é cedido para o átomo mais eletronegativo em uma ligação iônica, tornando-se o cátion Na+. O enxofre (S), por sua vez, é muito eletronegativo e recebe 2 elétrons para completar 8 e se estabilizar como o ânion S2-, logo, o composto iônico formado por esses elementos deve ser Na2S:
2 Na+ + S2- → Na2S
Letra C
