78 Soluções aquosas de ácido clorídrico, HCl (aq), e de ácido acético, H3CCOOH (aq), ambas de concentração 0,10 mol/L, apresentam valores de pH iguais a 1,0 e 2,9, respectivamente.
Em experimentos separados, volumes iguais de cada uma dessas soluções foram titulados com uma solução aquosa de hidróxido de sódio, NaOH (aq), de concentração adequada. Nessas titulações, a solução de NaOH foi adicionada lentamente ao recipiente contendo a solução ácida, até reação completa. Sejam V1 o volume da solução de NaOH para reação completa com a solução de HCl e V2 o volume da solução de NaOH para reação completa com a solução de H3CCOOH. A relação entre V1 e V2 é
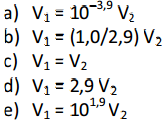
Resposta C
Os ácidos clorídrico e acético apresentam a mesma concentração em mol/L (MA = 0,10 mol/L).
A proporção em mols entre ácido e base (NaOH) é 1:1.
Os volumes de cada ácido a serem titulados são iguais (VA).
concentração da base * volume base = concent. ácido * volume ácido
No primeiro caso, temos:
NaOH + HCl → NaCl + H2O
MBV1 = MAVA
No segundo caso, temos:
NaOH + CH3COOH → CH3COO–Na+ + H2O
MBV2 = MAVA
Igualando MBV1 = MBV2
Assim, V1 = V2
