O ferro é encontrado na natureza na forma de seus minérios, tais como a hematita (alfa-Fe2O3), a magnetita (Fe3O4) e a wustita (FeO). Na siderurgia, o ferro-gusa é obtido pela fusão de minérios de ferro em altos fornos em condições adequadas. Uma das etapas nesse processo é a formação de monóxido de carbono. O CO (gasoso) é utilizado para reduzir o G=FeO (sólido), conforme a equação química:
![]()
Considere as seguintes equações termoquímicas:
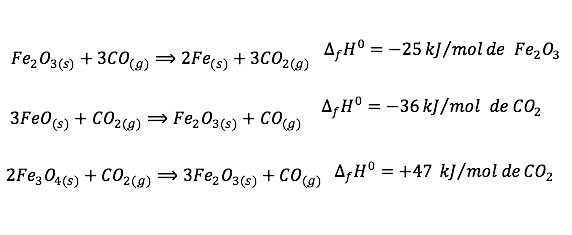
O valor mais próximo de DH, em kJ/mol de Feo, para a reação indicada do FeO (sólido) com o CO ( gasoso) é
- -14.
- -17
- -50
- -64.
- -100
Solução
Queremos encontrar a entalpia da reação: ![]()
Para isso, vamos chamar as equações de I, II e III:
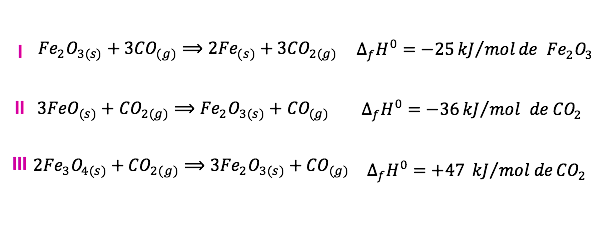
Vamos dividir I por 2, II por 3 e III por 6:
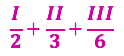
Como sabemos isso? Veja que queremos 1FeO, então pra isso teríamos que dividir II por 3. A partir da decisão sobre a equação II fazemos as duas outras (I e III).
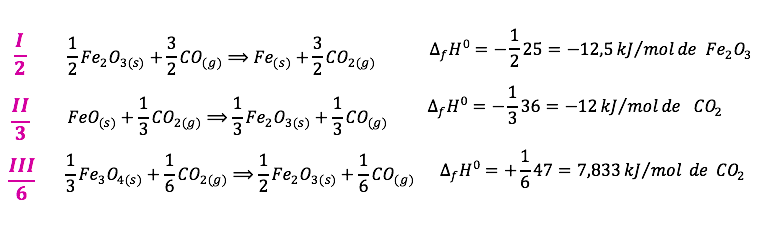
Somando as equações acima chegamos em:
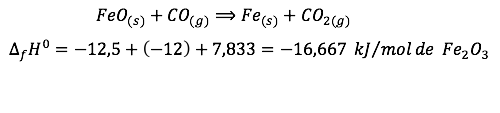
Veja que dividimos também as entalpias de formação.
Letra B
