O ácido acetilsalicílico, AAS (massa molar igual a 180 g/mol) é sintetizado a partir da reação do ácido salicílico (massa molar igual a 138 g/mol) com anidrido acético, usando-se ácido sulfúrico como catalisador, conforme a equação química:
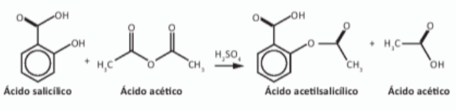
Após a síntese, o AAS é purificado e o rendimento final é de aproximadamente 50%. Devido às propriedades farmacológicas (antitérmico, analgésico e anti-inflamatório e antitrombótico), o AAS é utilizado como medicamento nas formas de comprimidos, nos quais se emprega tipicamente uma massa de 500 mg dessa substância.
Uma indústria farmacêutica pretende fabricar um lote de 900 mil comprimidos, de acordo com as especificações do texto. Qual é a massa de ácido salicílico, em kg, que deve ser empregada para esse fim?
- 293
- 345
- 414
- 690
- 828
Solução
Precisamos fazer uma regra de 3:

Assim encontramos 450 kg de AAS – ácido acetil salicílico.
Porém, a questão nos pede a massa de AS – ácido salicílico.
Abaixo fazemos as contas considerando um rendimento de 50% na reação.
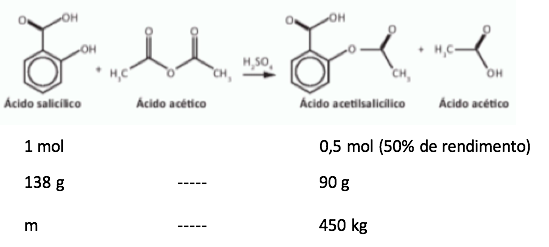
Fazendo a regra de 3: 138×450÷90 =690 kg.
Outra forma de resolver é:
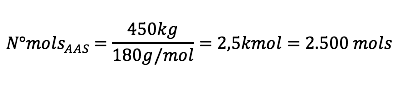
Perceba que o rendimento é de 50%, ou seja, para cada 1 mol de AS só é produzido 0,5 mol de AAS. Então o número de mols de AS será o dobro do número de mols de AAS:
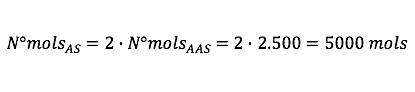
![]()
Letra D

