A química verde permite o desenvolvimento tecnológico com danos reduzidos ao meio ambiente, e encontrar rotas limpas tem sido um grande desafio. Considere duas rotas diferentes utilizadas para a obtenção de ácido adípico, um insumo muito importante para a indústria têxtil e de plastificantes.
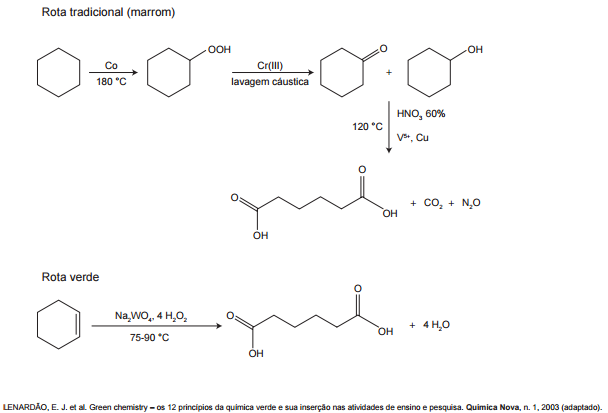
LENARDAO, E.J. et al. Greon chemistry – Os doze Princípios da Química Verde e sua inserção nas atividades de ensino e pesquisa. Química Nova n.1 2003 (adaptado).
Que fator contribui positivamente para que a segunda rota de síntese seja verde em comparação à primeira?
a) Etapa única na síntese.
b) Obtenção do produto puro.
c) Ausência de reagentes oxidantes.
d) Ausência de elementos metálicos no processo.
e) Gasto de energia nulo na separação do produto.
Solução
Analisando as alternativas, vemos que a E não faz sentido porque a reação verde também demanda energia (veja o aquecimento necessário). A letra C não pode porque há sim a presença de reagentes oxidantes, pois, a água oxigenada H2O2 é reagente no processo, embora o diagrama da reação verde mostre-a como catalisadora.
A letra B não pode porque não há apenas a obtenção do produto puro, também é formada água.
Restam-se nos as letras A e D.
Achamos que o enunciado foi incompleto, então pesquisamos melhor a síntese do ácido adípico. Veja esta publicação do Conselho Regional de Química.
Esta é a reação marrom:
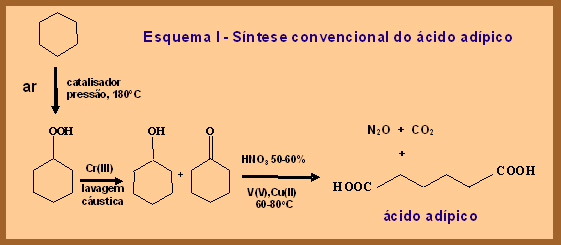
(1) o reagente ciclohexano é obtido através da hidrogenação (adição de hidrogênio) do benzeno, que é um derivado do petróleo altamente tóxico;
(2) o agente oxidante, ácido nítrico concentrado, é corrosivo;
(3) o processo envolve altas temperaturas, várias etapas de síntese, uso de diversos catalisadores (substâncias que aceleram uma reação química) e de substâncias tóxicas (como sais de crômio);
(4) no final da reação, há emissão de gases poluentes, que causam destruição da camada de ozônio (N2O) e o efeito estufa (CO2 e N2O).
Por outro lado, a reação verde:
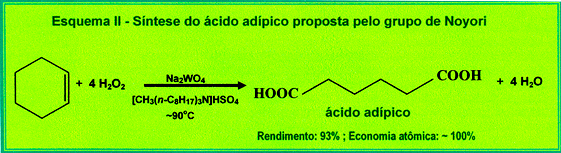
(1) menor gasto de energia com o uso de temperatura moderada;
(2) redução do tempo total de reação – uma só etapa. Neste ponto o enunciado poderia ter sido mais claro, porque o aluno não precisa saber que por ser uma etapa, ela será automaticamente mais rápida que as outras três, porque isso nem sempre ocorre, e existem vários contra-exemplos.
(3) economia de átomos e maior rendimento;
(4) uso de pequena quantidade de catalisador e de um agente oxidante menos agressivo;
(5) geração de água (subproduto atóxico).
Letra A.
