Vários ácidos são utilizados em indústrias que descartam seus efluentes nos corpos d’água, como rios e lagos, podendo afetar o equilíbrio ambiental. Para neutralizar a acidez, o sal carbonato de cálcio pode ser adicionado ao efluente, em quantidades apropriadas, pois produz bicarbonato, que neutraliza a água. As equações envolvidas no processo são apresentadas:
(I) CaCO3 (s) + CO2 (g) + H2O (l) <-> Ca2+ (aq) + 2 HCO3– (aq)
(II) HCO3– (aq) <-> H+ (aq) + CO32- (aq) K1 = 3,0×10-11
(III) CaCO3 (s) <-> Ca2+ (aq) + CO32- (aq) K2 = 6,0×10-9
(IV) CO2 (g) + H2O (l) <-> H+ (aq) + HCO3– (aq) K3 = 2,5×10-7
Com base nos valores das constantes de equilíbrio das reações II, III, IV a 25oC, qual é o valor numérico da constante de equilíbrio da reação I?
a) 4,5×10-26
b) 5,0×10-5
c) 0,8×10-8
d) 0,2×10-5
e) 2,2×1026
Solução
(III) CaCO3 (s) <-> Ca2+ (aq) + CO32- (aq) K2 = 6,0×10-9
+
(IV) CO2 (g) + H2O (l) <-> H+ (aq) + HCO3– (aq) K3 = 2,5×10-7
+ contrário de II:
(-II) H+ (aq) + CO32- (aq) <-> HCO3– (aq) Kcontrário = 1/K1 =1/(3,0×10-11)
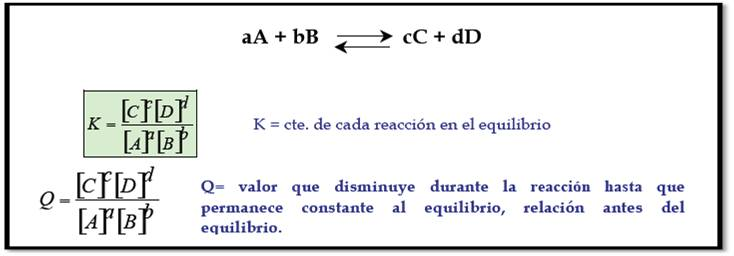
Quando invertemos o sentido da reação, a constante de reação passa a ser o inverso. Na linha anterior, 1/K1. Para entender essa manobra é útil ver a definição de K.
Para uma reação: A + B -> C + D
K direto= [C].[D]/([A].[B])
Se invertermos a reação: C + D -> A + B
K inverso=[A].[B]/([C].[D]).= 1/Kdireto
Assim, a soluçào fica
K_final = K2.K3/K1 = 6,0×10-9.2,5×10-7/(3,0×10-11) = 5,0×10-5
Letra B