Um sistema de pistão contendo um gás é mostrado na figura. Sobre a extremidade superior do êmbolo, que pode movimentar-se livremente sem atrito, encontra-se um objeto. Através de uma chapa de aquecimento é possível fornecer calor ao gás e, com auxílio de um manômetro, medir sua pressão. A partir de diferentes valores de calor fornecido, considerando o sistema como hermético, o objeto elevou-se em valores Δh, como mostrado no gráfico.
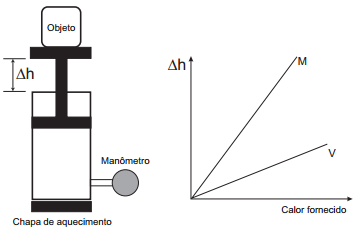
Foram estudadas, separadamente, quantidades equimo – lares de dois diferentes gases, denominados M e V. A diferença no comportamento dos gases no experimento decorre do fato de o gás M, em relação ao V, apresentar
a) maior pressão de vapor.
b) menor massa molecular.
c) maior compressibilidade.
d) menor energia de ativação.
e) menor capacidade calorífica.
Resposta E
Precisaremos usar duas equações da termodinâmica:
1 Equação dos gases PV=nRT
PV=nRT
V=A*H (A=área, H=altura)
PAH=nRT
H=nRT/PA
Chamando nR/PA de uma constante k. Temos:
H=kT, assim a altura atingida depende só da temperatura alcançada pelo gás.
Agora, a temperatura que o gás atingirá dependerá da sua capacidade calorífica. A capacidade calorífica é, na prática, o quanto a temperatura vai aumentar para uma dada quantidade de calor fornecida:
– Equação da capacidade calorífica Q = C*T
Em resumo, a altura atingida dependerá da temperatura do gás. No entanto, a temperatura do gás dependerá da capacidade calorífica (o quanto o calor fornecido será transformado em temperatura).
