As fraldas descartáveis que contêm o polímero poliacrilato de sódio (1) são mais eficientes na retenção de água que as fraldas de pano convencionais, constituídas de fibras de celulose (2).
A maior eficiência dessas fraldas descartáveis, em relação às de pano, deve-se às
- interações dipolo-dipolo mais fortes entre o poliacrilato e a água, em relação às ligações de hidrogênio entre a celulose e as moléculas de água.
- interações íon-íon mais fortes entre o poliacrilato e as moléculas de água, em relação às ligações de hidrogênio entre a celulose e as moléculas de água.
- ligações de hidrogênio mais fortes entre o poliacrilato e a água, em relação às interações íon-dipolo entre a celulose e as moléculas de água.
- ligações de hidrogênio mais fortes entre o poliacrilato e as moléculas de água, em relação às interações dipolo induzido-dipolo induzido entre a celulose e as moléculas de água.
- interações íon-dipolo mais fortes entre o poliacrilato e as moléculas de água, em relação às ligações de hidrogênio entre a celulose e as moléculas de água.
SOLUÇÃO
Resumo de forças intermoleculares e intramoleculares
Para resolver essa questão precisamos entender que temos as forças intermoleculares ocorrem entre moléculas e forças intramoleculares ocorrem dentro de uma única molécula, são o que mantém os átomos ligados.
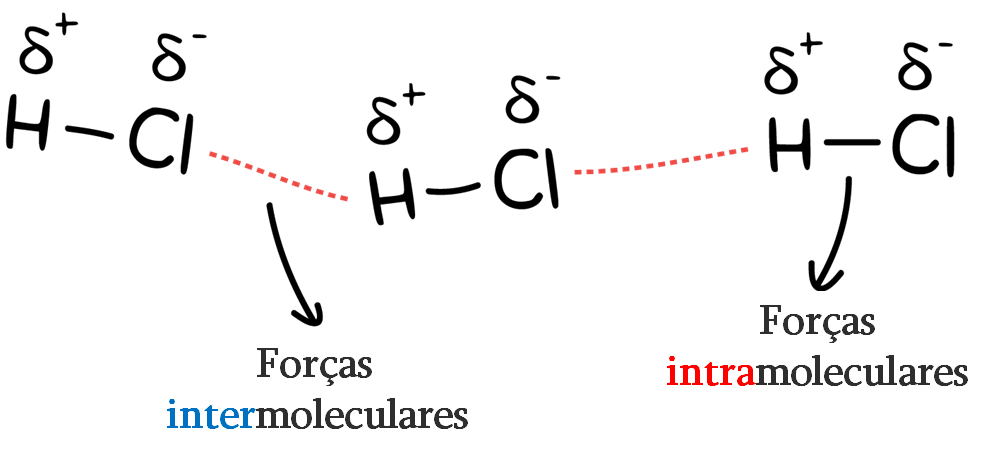
Resumo de forças intramoleculares
Existem 3 tipos de forças intramoleculares:
1 – ligação iônica
É formada pela transferência completa de elétrons de valência entre os átomos. É um tipo de ligação química que gera dois íons carregados de forma oposta.
Em ligações iônicas, o metal perde elétrons para se tornar um cátion carregado positivamente, enquanto que o não-metal aceita esses elétrons para se tornar um ânion com carga negativa.

2 – ligação covalente
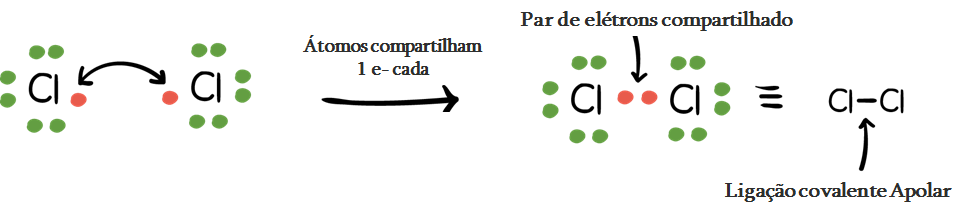
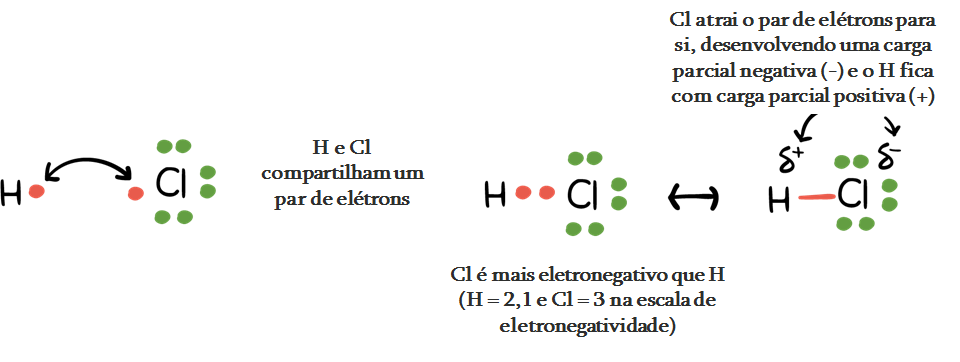
A ligação covalente é formada entre átomos que possuem eletronegatividade semelhante – a afinidade ou desejo por elétrons. Como ambos os átomos têm afinidade semelhante para os elétrons e nem tendem a doá-los, eles compartilhamelétrons para conseguir a configuração do octeto e se tornam mais estáveis.
Uma ligação covalente não-polar é formada entre os mesmos átomos ou átomos com eletronegatividades muito semelhantes – a diferença de electronegatividade entre átomos colados é inferior a 0,5.
Uma ligação covalente polar é formada quando átomos de eletronegatividades ligeiramente diferentes compartilham elétrons. A diferença na eletronegatividade entre os átomos colados é entre 0,5 e 1,9.
3 – ligação metálica
Ligação metálica: Este tipo de ligação covalente ocorre especificamente entre átomos de metais, nos quais os elétrons de valência são livres para se moverem pela rede.
Essa ligação é formada através da atração dos elétrons móveis – conhecido como mar de elétrons – e os íons metálicos fixos carregados.
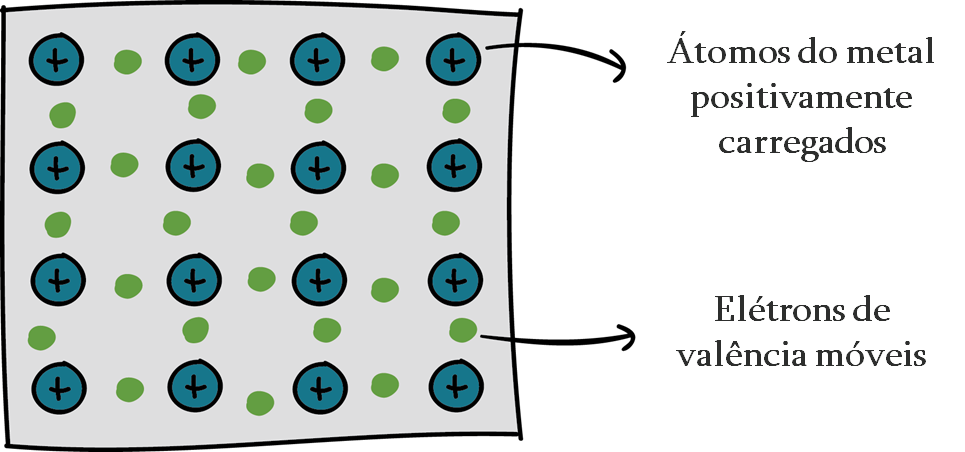
As ligações metálicas estão presentes em amostras de metais elementares puros, como ouro ou alumínio, ou ligas, como bronze ou bronze.
Os elétrons que circulam livremente em metais são responsáveis por sua propriedade refletiva – os elétrons de movimento livre oscilam e liberam fótons de luz – e sua capacidade de conduzir calor e eletricidade efetivamente.
Comparação da força de atração intramolecular
| Força intramolecular | Formação | Força relativa |
| Ligação metálica | Cátions metálicos com mar de elétrons | 1, mais forte |
| Ligação iônica | Cátions doa e- para ânions | 2 |
| Ligação covalente polar | Cátion parcialmente carregado com ânion parcialmente carregado | 3 |
| Ligação covalente apolar | núcleos com elétrons compartilhados | 4, mais fraco
|
Resumo de forças intermoleculares
Existem 3 tipos de forças intermoleculares:
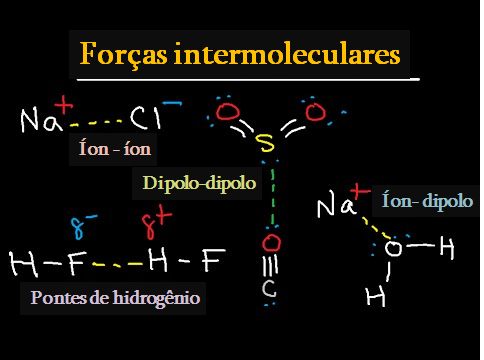
1 – Interações dipolo-dipolo:
Ocorrem quando a parte parcialmente carregada positivamente (+) de uma molécula interage com a parte parcialmente carregada negativamente (-) da molécula vizinha. Podem ser do tipo íon-dipolo quando uma das espécies do dipolo for um íon.
É necessário haver íons parcialmente carregados – por exemplo, o caso de ligações covalentes polares, como cloreto de hidrogênio H – Cl.
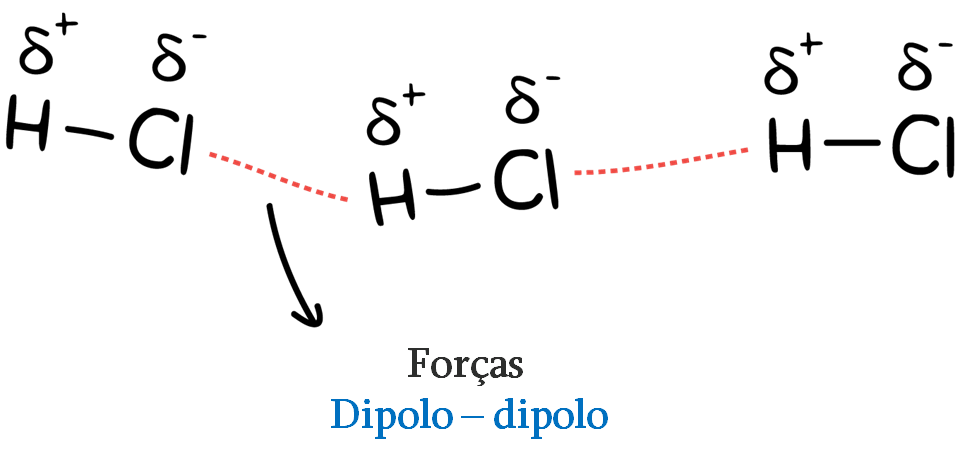
As interações dipolo-dipolo são a força intermolecular mais forte de atração.
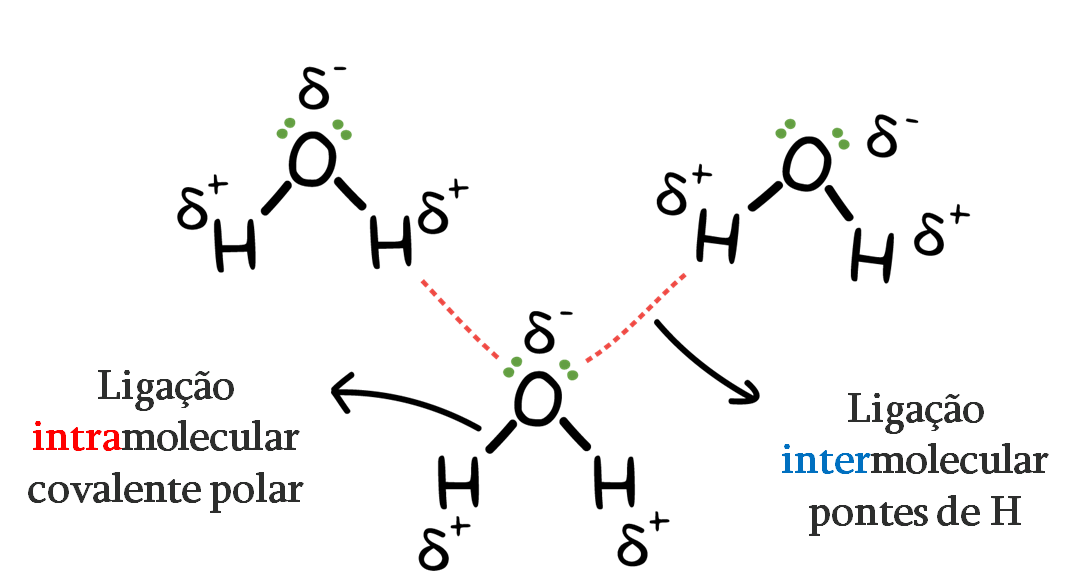
2 – Pontes de hidrogênio
É tipo especial de interação dipolo-dipolo que ocorre especificamente entre um átomo de hidrogênio ligado a um átomo de oxigênio, nitrogênio ou flúor.
A extremidade parcialmente positiva do hidrogênio é atraída para a extremidade parcialmente negativa do oxigênio, nitrogênio ou flúor de outra molécula.
A ligação de hidrogênio é uma força relativamente forte de atração entre moléculas, e é necessária energia considerável para quebrar as ligações de hidrogênio. Isso explica os pontos de ebulição excepcionalmente altos e os pontos de fusão de compostos como a água.
3 – Forças de dispersão de London
= Forças de van der Waals
São as forças intermoleculares mais fracas e existem entre todos os tipos de moléculas, seja iônica ou covalente-polar ou não polar. Quanto mais elétrons uma molécula tem, mais fortes são as forças de dispersão de Londres.
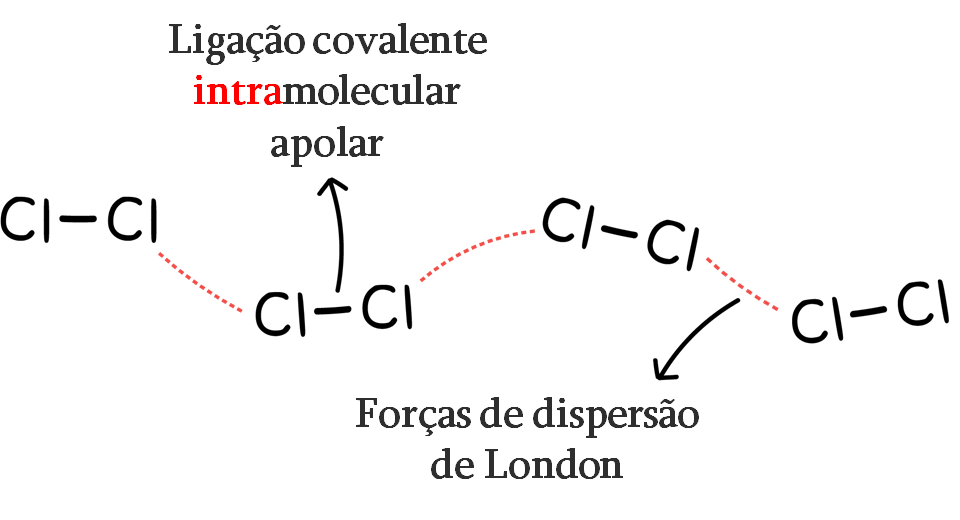
Tabela de comparação da força intermolecular
| Força intermolecular | ocorre entre | Força relativa |
| Atração dipolo – dipolo ou íon-dipolo | íons com carga oposta | Mais forte |
| Pontes de Hidrogênio | Tão forte quanto dipolo-dipolo | |
| Forças de dispersão de london – van der Waals | Dipolo induzido ou temporário | Mais fraca |
SOLUÇÃO DA QUESTÃO
As fraldas serão mais eficientes em absorver a água quanto maior for a força de interação molecular da fralda com a água do xixi do bebê. Portanto, estamos falando em forças de ligação INTERmolecular.
Na fralda descartável, teremos então a interação do íon-dipolo, que será a interação de um composto iônico (poliacrilato) com um composto fortemente polar (água).
E na fralda de pano teremos pontes de hidrogênio.
Vimos na tabela de forças de ligação intermolecular que as forças dipolo-dipolo (= íon – dipolo) são mais fortes que as pontes de hidrogênio. Assim, chegamos na letra E.
Você gostou dessa resolução?
LETRA E
