A formação frequente de grandes volumes de pirita (FeS2) em uma variedade de depósitos minerais favorece a formação de soluções ácidas ferruginosas, conhecidas como “drenagem ácida de minas”. Esse fenômeno tem sido bastante pesquisado pelos cientistas e representa uma grande preocupação entre os impactos da mineração no ambiente. Em contato com oxigênio, a 25 °C, a pirita sofre reação, de acordo com a equação química:
4 FeS2(s) + 15 O2(g) + 2 H2O(l) → 2 Fe2(SO4)3(aq) + 2 H2SO4(aq)
FIGUEIREDO, B. R. Minérios e ambiente. Campinas: Unicamp, 2000.
Para corrigir os problemas ambientais causados por essa drenagem, a substância mais recomendada a ser adicionada ao meio é o
- sulfeto de sódio.
- cloreto de amônio.
- dióxido de enxofre.
- dióxido de carbono.
- carbonato de cálcio.
![]()
Em solução aquosa, teríamos a hidrólise do íon sulfeto, obtendo uma solução básica:
![]()
Até aí tudo bem, porém, ao reagir o sulfeto de sódio com o ácido sulfúrico, produziríamos ácido sulfídrico novamente. O ácido sulfídrico é tóxico e não nos ajuda a corrigir os problemas ambientais. Logo, a letra A está incorreta.
![]()
b) Cloreto de amônio
![]()
Mesmo sem saber isso, poderíamos lembrar que o íon NH4+ pode liberar H+ em solução:
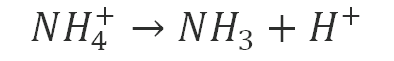
Logo, b incorreta.
c) dióxido de enxofre
É um óxido ácido. Não atende ao requisito de ser básico nem de não prejudicar o meio ambiente. (c é incorreta)
![]()
d) dióxido de carbono
Aqui novamente estamos diante de um óxido ácido, ele reagirá com a água formando ácido carbônico. (d é incorreta)
![]()
e) correta
O carbonato de cálcio é um sal formado a partir dode um ácido fraco (ácido carbônico) e uma base forte (hidróxido de cálcio):
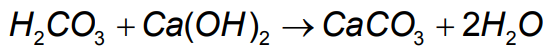
Portanto, é um sal básico.
O carbonato de cálcio poderá reagir com o ácido sulfúrico seguindo a seguinte equação:
![]()
O ácido carbônico formado se decomporá em água e gás carbônico, e não será um problema ao meio ambiente.
![]()
