No ar que respiramos existem os chamados gases inertes”. Trazem curiosos nomes gregos, que significam “O Novo”, “o Oculto”, “o Inativo”. E de fato são de tal modo inertes, tão satisfeitos em sua condição, que não interferem em nenhuma reação química, não se combinam com nenhum outro elemento e justamente por esse motivo ficaram sem ser observados durante séculos: só em 1962 um químico, depois de longos e engenhosos esforços, conseguiu forçar “o Estrangeiro” (o Xenônio) a combinar-se fugazmente com o flúor ávido e vivaz, e a façanha pareceu tão extraordinária que lhe foi conferido o Prêmio Nobel.
Qual propriedade do flúor justifica sua escolha como reagente para o processo mencionado?
- Densidade.
- Condutância.
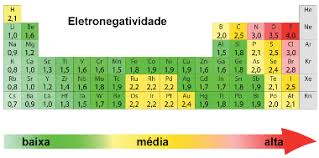
- Eletronegatividade
- Estabilidade nuclear
- Temperatura de ebulição.
Solução
Com certeza, a eletronegatividade. Será a tendência do flúor em “atacar” outros átomos. O flúor é o elemento mais eletronegativo da tabela periódica.
A eletronegatividade é a força que um átomo tem em atrair elétrons.
O flúor é um átomo muito pequeno, com poucas camadas eletrônicas, e assim o núcleo do átomo de flúor tem uma força muito grande para atrair elétrons. Assim, o flúor atrai os elétrons do Xenônio.
Letra C.
