Em um experimento, colocou-se água até a metade da capacidade de um frasco de vidro e, em seguida, adicionaram-se três gotas de solução alcoólica de fenolftaleína. Adicionou-se bicarbonato de sódio comercial, em pequenas quantidades, até que a solução se tornasse rosa. Dentro do frasco, acendeu-se um palito de fósforo, o qual foi apagado assim que a cabeça terminou de queimar. Imediatamente, o frasco foi tampado. Em seguida, agitou-se o frasco tampado e observou-se o desaparecimento da cor rosa.
MATEUS. A. L Química na cabeça. Belo Horizonte. UFMG, 2001 (adaptado)
A explicação para o desaparecimento da cor rosa é que, com a combustão do palito de fósforo, ocorreu o(a)
a) formação de óxidos de caráter ácido.
b) evaporação do indicador fenolftaleína.
c) vaporização de parte da água do frasco.
d) vaporização dos gases de caráter alcalino.
e) aumento do pH da solução no interior do frasco.
Resposta
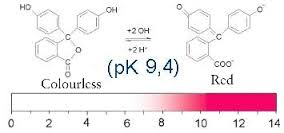
A fenolftaleína indica o PH de uma solução através de sua cor. Em PHs básicos, ou seja, maiores que 7, a cor vai ficando rosada. Em PHs ácidos, ou seja, menor que 7, a fenolftaleína fica na sua forma incolor.
A hidrólise de NaHCO3 liberará íons bicarbonato:
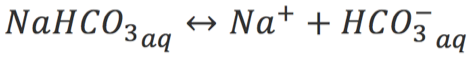
Em seguida o bicarbonato reagirá com a água, produzindo meio básico, o que torna a solução rosada: 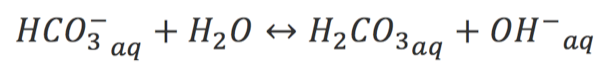
Depois, o enunciado nos fala de uma combustão dentro do frasco. Sabemos que em uma combustão há liberação de óxidos ácidos como CO2 e SO2. Sendo o CO2 o mais comum, vamos ver uma reação entre o CO2 e a água: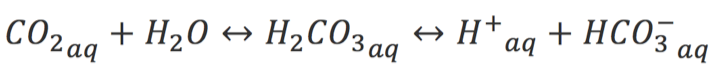
Letra A
No próximo ENEM, é possível que caia o papel de tornassol, que também é utilizado no diagnóstico de meios ácidos e básicos. Este apresenta a cor azul em meio ácido(PH < 7)., e cor vermelha em meio básico (PH > 7).

